欢迎来到高新区数耕网络科技工作室-专业无纺布袋定制、批发生产厂家! 381708881@qq.com 18482170382 |
细胞表面相关和细胞外基质 (ECM) 嵌入分子的时空组织模式在组织的发育和功能中起着重要作用。ECM 蛋白与生物支架聚合物的表面相互作用,并影响材料驱动的细胞分化控制。使用 X 射线相位对比微型计算机断层扫描 (microCT),我们在体外接种诱导成肌分化、用氧化铁纳米粒子标记并接种到聚乙醇酸-聚乳酸支架上的骨髓衍生人类和鼠间充质干细胞 (MSC) 后,可视化了 ECM 组织的三维 (3D) 图像。X 射线 microCT 使我们能够以高空间分辨率检测生物支架内 ECM 的 3D 结构组织以及细胞的存在如何改变构造排列。观察到人类和鼠细胞产生的基质之间的物种特异性差异。总之,X 射线同步辐射 microCT 分析似乎是识别生物支架内 ECM 纤维组织时空模式的有用工具。
一、简介
任何组织的工程都需要考虑材料和生物科学,并涉及支架材料和细胞之间的复杂相互作用。材料和细胞的最佳组合的选择取决于在不同实验条件下对这些组合项目性能的灵敏和定量测量。成像方式对工程组织的发育有巨大影响,需要设计创新的图像处理方法。
微型计算机断层扫描 (microCT) 是最先进的非侵入性技术之一,旨在定性和定量评估不同条件下的组织生长。它主要用于评估骨折愈合、骨骼发育和骨组织工程中的骨组织发育和再生。我们展示了使用 microCT 作为一种高空间分辨率(1.65 毫米)实验技术来检测用氧化铁纳米粒子标记的干细胞的可能性,这些干细胞在体外动脉内移植到营养不良小鼠的骨骼肌中。该技术还提供了获得细胞分布的 3D 可视化的可能性。我们研究的数据表明,使用 microCT 可以可视化肌肉活检中动脉内注射的 CD133+ 干细胞的分布,从而为肌肉干细胞归巢的早期过程提供生物学见解。
不同类型的肌祖细胞已用于设计骨骼肌组织,包括肌肉来源的干细胞、骨髓来源的 MSCs、神经干细胞和循环 CD133+ 细胞。结合我们之前使用 X 射线微 CT 分析 MSC=生物支架结构用于组织工程以及在体内检测肌祖细胞命运的经验,我们测试了使用同步加速器分析揭示工程组织三个组成部分之间的结构相互作用的可行性:生物材料、细胞和细胞外基质 (ECM)。
生物支架为细胞附着和组织发育提供了模板。理想情况下,支架结构决定了营养物质和代谢物进出细胞的运输。支架的空间结构和化学性质在细胞内信号传导和基因表达中发挥着作用。
不同的材料已被用作肌肉组织工程的支架,特别是天然衍生材料,如胶原蛋白和藻酸盐;细胞组织基质,如膀胱粘膜下层和小肠粘膜下层;和合成聚合物,特别是聚乙醇酸 (PGA),合成聚合物具有一些优点,例如使用非酶水解进行聚合物降解,并产生源自 PGA、PLLA 和 PLGA 的无毒分子,这些分子自然代谢并最终以二氧化碳和水的形式从体内排出。根据文献数据以及我们对不同生物材料加载后细胞活力的初步测试结果,我们选择 PGA/PLLA(50% 的 PGA 和 PLLA 混合物)作为合适的生物支架。
二、材料和方法
2.1 细胞
在获得知情同意后,从健康供体(年龄范围为 31-42 岁)的髂嵴骨髓抽吸物中获得人类间充质干细胞 (hMSC)。如前所述,从 C57Bl=6 小鼠中获得小鼠间充质干细胞 (mMSC)。简而言之,杀死小鼠,用冷磷酸盐缓冲盐水 (PBS) 冲洗股骨和胫骨中的有核细胞,从而收集骨髓细胞。动物的护理和使用符合意大利卫生部的法律和欧洲共同体的指导方针。
在 Ficoll 分离液上纯化有核细胞。将小鼠和人类细胞(10×10^6 有核细胞 = 10 厘米培养皿)培养在 Coon 改良的 F12 培养基中,该培养基中补充有 10% 胎牛血清 (FCS)、2 mM L-谷氨酰胺和 50 μg/mL 青霉素 = 链霉素(完全培养基)。在任何阶段均未添加细胞因子。培养物在 37℃ 下在 5% 二氧化碳 (CO2) 的环境中孵育。3 天后,去除未粘附的细胞以消除造血来源的污染细胞。当细胞融合度达到 90% 时,将贴壁细胞用胰蛋白酶消化(0.05% 胰蛋白酶 = 乙二胺四乙酸,37℃,10 分钟)并扩增(P1 阶段)。
2.2 MSCs 成肌分化诱导和细胞标记
mMSCs 和 hMSC 被诱导体外分化为成肌谱系,如前所述。简而言之,在第一代培养物(P1)收集 MSCs,将其重新接种到 6 孔板中,并在含有 1 ng=mL 碱性成纤维细胞生长因子 (bFGF) 的完全培养基中以 5×10^3 细胞/孔的密度培养。
当细胞达到融合度时,用 10 μM=L 5-氮杂胞苷 (5-Aza) (Sigma) 处理 24 小时(条件培养基)来诱导成肌分化。治疗结束时,去除条件培养基,将细胞在完全培养基中培养 2 周,然后进行标记。为了测试 MSCs 在 PGA/PLLA 支架内的分布和成肌承诺,我们使用氧化铁纳米粒子标记 MSCs,这样可以使用微型 CT 进行 3D 可视化。Endorem 是一种黑色至红棕色的超顺磁性氧化铁水溶胶体,与葡聚糖结合,用于静脉内给药。用 250 μg/mL 氧化铁纳米粒子标记细胞,总铁含量为 11.2 mg mL^(-1),由小的超顺磁性氧化铁颗粒组成。晶体尺寸从 4.3 到 5.6 nm 不等,平均粒径为 150 nm。标记是将氧化铁颗粒在标准细胞培养基中在 37℃、5% CO2 的环境下共培养 24 小时。
在标记实验结束时,去除含有过量颗粒的培养基,并用无菌磷酸盐缓冲盐水 (PBS) 清洗间充质细胞三次,如前所述,将 Endorem 以 250 μg/mL 的浓度添加到培养基中。标记细胞在 37℃、5% CO2 的环境下培养 24 小时。
2.3 支架
支架由 PGA 和 PLLA 无纺布纤维的生物毡组成,每种纤维的百分比为 50%(现为 BIOFELT,Concordia Fibers,Coventry RI)。支架厚 0.5 毫米,密度为 50 mg/cc,平均直径为 18 μm。支架是一种高度多孔的毡结构(孔隙率 > 97%),孔隙相互连通,孔径通常在 50 至 200 μm 之间。

东莞市富临塑胶原料有限公司 是 Confluent Medical 在中国的合作伙伴,富临塑胶为中国客户提供“服务”和供应“PGA Biofelt无纺布”。
将材料切成大约 1 cm² 面积和 500 mm 厚的薄片。
2.4 细胞接种
孵育并用 5-Aza 处理后,利用重力将 50×10^4 Endorem 标记的 MSCs 接种到 PGA/PLLA 支架上。
将细胞-支架构建体在 Coon’s F12 培养基中培养 15 天,培养基中添加的 FCS 数量逐渐减少,从 5% 血清浓度开始逐渐减少到 1% 血清(饥饿状态),以促进 MSCs 的成肌承诺。
为了检查接种的细胞是否经历了成肌细胞分化,将一些样品放入裂解缓冲液,并使用RNeasy Mini试剂盒(Qiagen)提取总RNA。用DNAse(无Rnase的DNA酶组,Qiagen)处理RNA以避免基因组DNA的污染。我们使用Superscript II第一链合成系统(Invitrogen)合成互补DNA(cDNA)。
我们使用标记物 MyoD 的引物进行逆转录聚合酶链反应,正向引物:5-ATCC GCTACATCGAAGGTCT-3,反向引物:5-CTCTGGTGTGCA TCTGCCA-3;肌生成素正向引物:5-CAGTACATTGAGCG CCTACA-3,反向引物:5-ACATATCCTCCACCGTGATG-3,结蛋白正向引物:5-ATCTCTGAGGCTGAAGAATGG-3,反向引物:5-GAGCAGAGAAGGTCTGGATAG-3。我们将基因表达水平与管家基因甘油醛-3-磷酸脱氢酶 (GAPDH) 的表达进行了比较。人类 GAPDH 正向引物:5-GAA GGTGAAGGTCGGAGTC-3,反向引物:5 -GAAGATG GTGATGGGATTTC-3。小鼠 GAPDH 正向引物:5 -CCATCTTCCAGGAGCGAGAC-3 ,反向引物:5 -GGC TAAGCAGTTGGTGGTGC-3 。
然后将其他样品在磷酸盐缓冲盐水 (PBS) 中清洗 1X,在 3.7% 多聚甲醛中固定 30 分钟,并在 70% 乙醇中保存以进行形态分析。
2.5 形态学研究
使用标准组织学技术将福尔马林固定的标本进行石蜡包埋。固定两个月后,切下 4 μm 的连续切片。用苏木精和伊红 (HE) 和过碘酸希夫 (PAS) 对切片进行染色以检查形态。
对于透射电子显微镜 (TEM) 分析,将标本固定在 0.1 M 二甲胂酸盐缓冲液 (pH 7.4) 中的 2% 戊二醛中,在 1% 四氧化锇中后固定,在不断增加的乙醇浓度中脱水,并嵌入 Araldite 中。使用 Eclipse E600 显微镜在 400X 下观察用甲苯胺蓝染色的半薄切片,使用 40X 物镜,N.A. 0.75。使用尼康 Coolpix 数码相机在 40X 下获取切片图像。使用飞利浦CM10 TEM 在 80 KV 下观察用醋酸铀酰和柠檬酸铅复染的超薄切片。
2.6 X 射线相位对比微 CT 成像和图像重建
使用微 CT 系统(Beamline BM05,欧洲同步辐射装置 (ESRF) 格勒诺布尔)对每个样品的 3D 结构形态进行非侵入式成像和量化。使用 20 KeV 能量的单色光束和 20 毫米的样品到探测器距离进行微 CT 实验。样品保存在 70% 乙醇中,在数据采集前风干。
采集设置基于先前描述的 3D 平行断层扫描。同步加速器成像序列期间样品吸收的总辐射量限制为 0.2 Gy。扫描样品,在 180° 范围内为每个样品获得 1500 个投影。每个投影的曝光时间为 1 秒。使用与 FReLoN 2048×2048 CCD 相机(ATEG,ESRF 仪器支持组)相关联的 Gadox 闪烁体作为探测器,像素大小设置为约 0.7 μm,可视场约为 1.5 mm。该系统获得各向同性的切片数据,并将其重建为 2D 图像。
使用在 ESRF 实施的 3D 滤波反投影算法,从一系列 2D 投影中获得样品的三维重建。此外,使用 3D 显示软件对不同的灰度相进行着色,使其更容易识别。为每个样本重建了几个约 (1000)³ 体素的子体积,其中体素是空间三个方向上大小为 0.7 毫米的立方体。
2.7 3D 可视化
体积渲染是一种 3D 可视化方法,通过该方法直接渲染数据体积而不将其分解为几何图元。使用 2 GHz Pentium 和 1 Gb 随机存取存储器以及商业软件 VGStudio MAX 1.1 生成 3D 图像并以 3D 形式可视化相的分布。为了获得最佳的图像质量设置,我们使用了 Scatter HQ 算法,过采样因子为 5.0,并激活了颜色渲染。
2.8 定量参数的提取
然后使用其他地方详细描述的 3D 平均截距长度 (MIL) 方法的实现对不同相进行量化。通过计算自动分离不同相的算法标记的体素数量来计算不同的体积。使用和中提出的算法测量感兴趣的支架传输特性,例如曲折指数、平均杨氏曲率、弯曲能量、圆度、凸度、偏心率和坚固性。
2.9 统计分析
结果表示为平均值±平均值的标准误差。使用 Sigma Stat 4.0 软件进行非配对学生 t 检验,统计显着性定义为 p < 0.05。
三、结果
3.1 支架结构的 3D 表征
在 MSC 接种之前对不同的 PGA/PLLA 样品进行成像。当使用光学显微镜、扫描电子显微镜、microCT 分析支架的子体积时,样品之间的内部微结构没有显著差异(图 1),表明图像彼此相关。使用 microCT 确认 PGA/PLLA 支架 (BIOFELT) 由纤维组成(图 1C)。然后使用空间计算分析技术量化 PGA/PLLA 纤维图像的 3D microCT。表 1 报告了从 3D microCT 扫描中提取的支架的结构和功能特征,例如纤维表面与纤维体积之比 (FS=FV)、纤维体积与总体积之比 (FV=TV)、平均直径纤维和纤维相平均长度。纤维直径的平均值±标准偏差为 15.5±4.7 μm。平均总孔隙率约为 95%。这些支架的测量定量参数与制造商报告的参数一致。由于传输特性会影响组织形成,我们还考虑了相关参数。根据 microCT 测量的支架传输特性如表 2 所示。所有支架样品的曲折指数似乎都有利于组织生长,考虑到 1.41 至 1.78 范围内的曲折度最适合通过全局互连的多孔空间进行质量传输。

图 1. 纯纤维聚乙醇酸-聚乳酸支架。间充质干细胞接种前支架子体积的光学 (A) 和扫描电子显微镜 (B) 显微照片以及三维微型计算机断层扫描图像 (C)。

表 1. 接种前支架的结构参数。

表 2. 接种前支架的运输特性。
3.2 细胞接种后对 PGA/PLLA 支架的修改
3D microCT 分析能够轻松区分空的 PGA/PLLA 结构和细胞负载的 PGA/PLLA 支架(图 2)。细胞-支架相互作用导致 PGA/PLLA 结构发生改变,产生的图像中明显存在两个具有不同衰减系数的不同相(图 2)。使用 3D 显示软件对不同相进行着色,使其更容易识别。未改性的 PGA/PLLA 纤维显示为绿色,由在生物支架上生长的细胞产生的纤维基质薄层显示为红色。这些层部分连接到纤维并覆盖了纤维本身网络中的某些区域(图 2B、C)。对于接种了 mMSC 和 hMSC 的支架,测量的层平均厚度分别为 5.4±1.3 μm 和 2.7±0.7 μm,两者均用铁纳米粒子标记(图 2B、C)。支架的正面部分强化了 3D 成像提供的信息(图 3A-C)。很容易看出,尽管在无细胞培养的支架中没有红色层状相的证据(图 3A),但在用 hMSC(图 3B)和 mMSC(图 3C)培养的支架中都可以看到该相。为了使这种证据更清晰,绘制了“体素数量与实验衰减系数”的曲线(图 3D)。
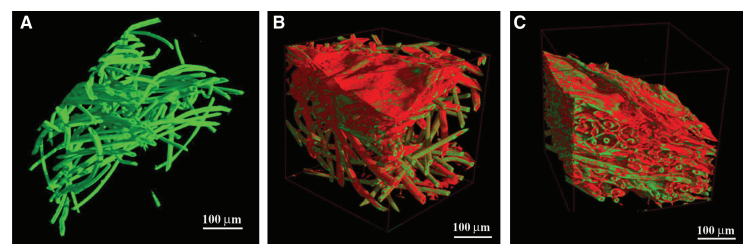
图 2. 接种间充质干细胞 (MSC) 之前和之后的纤维聚乙醇酸-聚乳酸支架。无细胞培养 (A) 和有人类 MSC (B) 和小鼠 MSC (C) 培养 15 天的支架子体积的三维 (3D) 显示,其中使用 3D 显示软件对不同阶段进行着色,以便更容易识别:纤维支架 (绿色)、薄细胞外基质 (红色)。
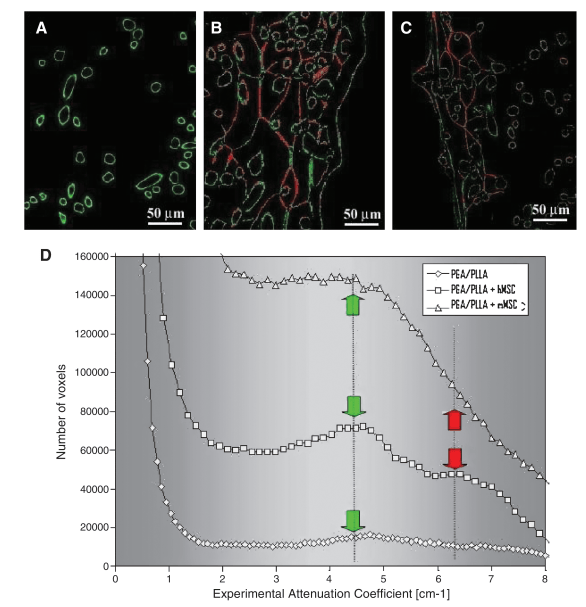
图 3. 新细胞外基质形成的证据。二维 (2D)(微型计算机断层扫描正面部分)显示培养 15 天的无细胞支架 (A)、有人类间充质干细胞 (hMSCs) (B) 和鼠间充质干细胞 (mMSCs) (C) 的支架亚体积,其中使用 3D 显示软件对不同阶段进行着色,以便更容易识别:纤维支架 (绿色)、薄层基质 (红色)。无细胞 (♢) 和有 hMSCs (□) 和 mMSCs (△) 的支架 (D) 的实验衰减系数直方图。绿色箭头表示聚乙醇酸-聚乳酸纤维;红色箭头表示新形成的纤维状基质。
为了从分析的样本中获得定量数据,对装有 hMSC 和 mMSC 的支架中新形成的层状结构进行了比较(图 4)。通过计算其相应的体素来计算缠绕在支架纤维(绿色)之间的新结构(图 3 中的红色)的数量,使用一种自动将其与其他相分离的算法。获得的数据以体素数(图 4A)和体积分数(细胞衍生结构体积=总体积=CV/TV)(图 4B)表示,这些体积分数在分析的样本体积(1.5 mm×1.5 mm×1.5 mm)中。
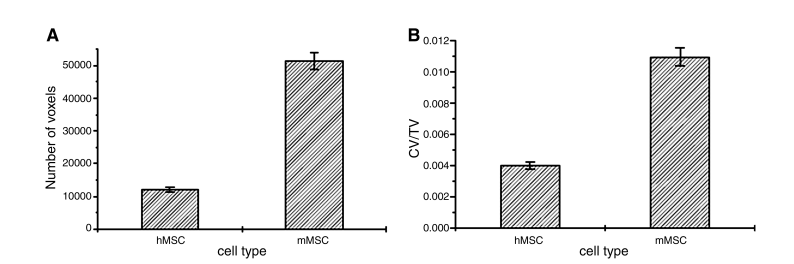
图 4. 支架内基质纤维的定量评估。(A) 对应于由人类间充质干细胞 (hMSC) 和鼠间充质干细胞 (mMSC) 沉积的基质纤维的体素数量。(B) hMSC 和 mMSC 沉积的基质纤维的体积分数 (细胞体积 = 总体积)。在这两种情况下,平均值和标准偏差均对应于在样本的小区域中获得的值,每个值均归一化为总分析样本体积 (1.5 mm×1.5 mm×1.5 mm)。
物种特异性定量差异决定了 hMSC 和 mMSC 产生的组织量;相同数量的加载 mMSC 产生的沉积基质数量明显更多。
3D 图像(图 5)的详细说明揭示了薄层纤维基质的存在,可能对应于纤维组织的特定时空模式。最初,一些细丝沉积在支架纤维上,形成稀疏结构(阶段 I);然后它们似乎以链状组织(阶段 II),最后细丝链层似乎以更厚的结构形式组织(阶段 III)。在装有 hMSC 和 mMSC 的样本中,纤维组织及其与支架的连接相似。

图 5. 使用 X 射线微型计算机断层扫描检测细胞外基质。支架纤维和沉积基质的三维显示 (A)。“阶段”被放大。基质原纤维最初沉积在支架纤维上 (阶段 I) (B)。在阶段 II,它们似乎在不同位置以链状排列 (C)。在第三阶段,链似乎在不同位置组织成网络,表明聚集过程有助于形成基质层 (D)。
3.3 PGA/PLLA 支架内新组织结构的表征
由于细胞被诱导成成肌细胞分化,我们首次尝试集中于检查新结构是否与肌肉形成的初始步骤相对应。培养 15 天后,从细胞-生物支架结构中提取总 RNA(数据未显示),标记物 MyoD、肌生成素和结蛋白的表达分析表明,hMSC 和 mMSC 的成肌分化特异性 cDNA 不存在(数据未显示),支持以下观点:加载的细胞仍留在支架内,没有经历成肌细胞分化(数据未显示)。
形态学分析显示 HE 和 PAS 染色切片中存在 MSC。新形成的组织被描述为透明基质,具有 PAS 阳性纤维状结构,在切片的某些部分看起来更致密(数据未显示),表明存在高比例的碳水化合物大分子,例如糖原、糖蛋白和蛋白聚糖,这些物质通常存在于结缔组织的 ECM 中。
光学显微镜分析确定该组织是由连接到支架结构的 ECM 纤维组成的结缔组织(图 6a)。一些含有铁颗粒的细胞遍布整个基质(图 6c)。没有发现有组织的骨骼肌组织(肌管或肌纤维)的证据。
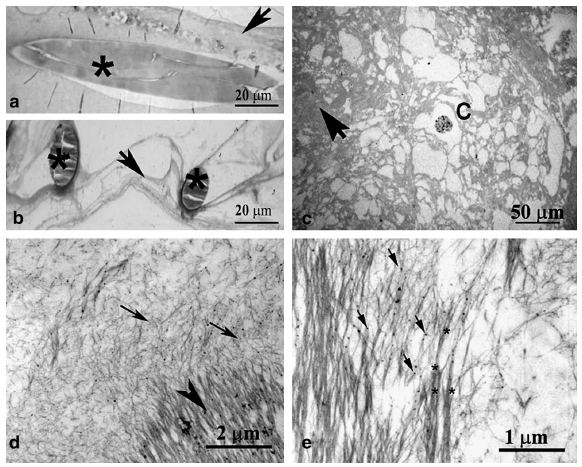
图 6. 聚乙醇酸-聚乳酸 (PGA/PLLA) 支架内细胞外基质 (ECM) 纤维的组织。使用光学 (a-c) 和电子 (d、e) 显微镜进行形态学研究。半薄切片表明存在胶原样纤维 (箭头),与纵向切片的 PGA/PLLA (*) 结构交织在一起 (a)。横截面中的 PGA/`PLLA (*) 被 ECM 材料包围 (b)。铁标记细胞 (C) 和纤维 ECM (箭头) 明显 (c)。透射电子显微镜 (TEM) 图像显示,由较厚的定向纤维结构 (箭头) 和随机定向的组织不良的细纤维 (箭头) 组成的两种不同成分 ECM (d)。在汇合区域观察到纤维组装方面的进展 (*)。电子致密体(箭头)可能与铁纳米粒子有关,可在 ECM 原纤维(e)上检测到。(a、b、c)在光学显微镜下观察到的甲苯胺蓝染色的半薄切片。(d、e)TEM 下的薄切片。
与同步加速器图像相呼应,薄切片的 TEM 分析(图 6d、e)表明,两种不同的成分由高度定向的长纤维结构和长度较短且随机定向的组织不良的纤维组成,分别在致密和疏松区域中具有相似的超微结构方面,反映了不同程度的基质组织,主要由 ECM 制成的胶原样纤维。在界面区,在更高的放大倍数下观察到纤维在致密有序基质中的组装进展(图 6e)。在 ECM 纤维中也可以检测到可能与铁纳米颗粒有关的电子致密体。
四、讨论
组织工程的目的是开发合适的生物材料和细胞组合来替代有缺陷的组织。当前的研究重点是控制生物支架结构内的细胞分化,祖细胞可以在其中找到有利于组织发育的微环境。一个重要的潜在混杂因素涉及细胞对这些材料及其微环境的分泌反应。细胞不断分泌复杂的 ECM 蛋白混合物和其他细胞行为调节剂,这可能会影响植入外源性细胞或材料时发生的情况。
我们的研究表明,PGA/PLLA 使 MSCs 倾向于分泌 ECM 蛋白,尽管用 5-Aza(一种用于诱导成肌分化的因子)处理,但仍可能延迟或阻碍其分化为骨骼肌细胞。缺乏成肌环境和机械力可能导致负载的 MSCs 无法分化为肌肉细胞。此外,PGA/PLLA 支架的 3D 结构可能会影响 MSCs 的行为,因为它们分散在支架内而没有细胞间接触。mMSC 分泌的 ECM 蛋白量高于 hMSC,证实了 MSC 的物种特异性行为。
尽管由于 X 射线吸收率低,不建议单独使用 microCT 来分析样本中的软组织,但我们能够使用下面描述的特殊装置检测支架纤维之间的 ECM 组织。与实验室或工业 X 射线源相比,使用同步加速器 X 射线有几个优势,包括高光子通量,允许以高空间分辨率进行测量;可调 X 射线源,允许以不同的能量进行测量;使用单色 X 射线辐射,消除了光束硬化效应;平行光束采集,允许使用精确的断层重建算法。此外,我们使用半相衬装置进行了实验,这增强了可视化不同相之间界面的可能性,在我们的实验中突出了 ECM 的组织。从同步加速器分析推断出的图像表明 ECM 纤维根据时空模式聚集。在支架的其他部分,孤立的胶原样纤维似乎聚集在逐渐变厚的层中,表明接种细胞不断分泌基质,覆盖了一些支架区域。铁标记细胞或铁纳米颗粒的存在似乎没有干扰X射线微CT对ECM结构的检测。在这种情况下,非侵入性和定量的X射线微CT可以被认为是挑战组织工程研究中新应用的潜在重要工具。当前的显微镜技术(例如本研究中也用于比较分析的TEM)仅限于2D局部信息,否则需要费力的3D连续切片重建。在这里,我们确定了使用同步加速器分析来描绘与PGA / PLLA生物支架接触的MSCs分层基质纤维网的精细时空组织的可行性。
责任编辑: