欢迎来到高新区数耕网络科技工作室-专业无纺布袋定制、批发生产厂家! 381708881@qq.com 18482170382 |
对于治疗严重的心脏瓣膜疾病,人工瓣膜在大多数成年人中效果相当好;然而,对于儿科患者,还有一个额外的要求,即更换瓣膜要随着孩子一起成长,因此极大地限制了目前的治疗选择。组织工程心脏瓣膜 (TEHV),例如源自自体骨髓干细胞 (BMSC) 的瓣膜,有可能重现天然瓣膜结构并适应躯体生长。然而,促进与天然组织的定向整合而不是随机、不受控制的生长的基本前提是了解 BMSC 对瓣膜相关机械环境的机械生物学反应。在这里,我们报告了人类 BMSC 接种聚合物结构对瓣膜相关应力状态的反应:(i) 单独稳定流动,(ii) 单独周期性弯曲,以及 (iii) 周期性弯曲和稳定流动 (弯曲流动) 的组合。将 BMSC 接种到 PGA:PLLA 聚合物支架上并在静态培养中培养 8 天。随后,再施加上述机械条件(组别包括稳定流(850ml/min)、周期性弯曲(1 Hz)和弯曲流(850ml/min 和 1 Hz)。我们发现弯曲流组的样本呈现瓣膜样细胞分布,这些细胞表达内皮细胞(偏向表面)和肌成纤维细胞(偏向中间区域)表型。我们认为这可能是由于存在明显的流体诱导剪切应力大小和振荡剪切应力,这些剪切应力同时施加在样本上。这些结果表明,弯曲流机械环境支持 BMSCs 体外定向分化为心脏瓣膜表型,这可通过细胞分布和特定基因标记的表达来证明。在柔性流动条件下,BMSC 衍生的工程组织生长的先验指导可能有助于随后促进体内受控的、工程化的天然组织整合过程,而这对于成功实现长期瓣膜重塑必不可少。
一、简介
心脏瓣膜在控制单向血流方面起着重要作用。然而,出生缺陷或感染(例如风湿热)可能导致一个或多个心脏瓣膜功能障碍,这可能导致儿童出现严重的瓣膜异常。植入物设计和手术技术的进步大大提高了成人患者人工心脏瓣膜的成功率。然而,由于这些植入物无法促进躯体生长和瓣膜组织重塑,因此其在儿科患者中的疗效受到严重限制;因此,多次大手术和再次手术很常见,这给成长中的孩子带来了巨大的健康负担。
与天然瓣膜类似,组织工程心脏瓣膜 (TEHV) 具有适应和随宿主进化的能力,在概念上被认为是治疗心脏瓣膜疾病的永久解决方案。在每个心动周期中,天然瓣膜都会因血流而不断受到机械应力;例如,主动脉瓣叶在收缩中期会经历由液体引起的峰值剪应力,约为 5-6 达因/厘米²。机械刺激应用于发育中的心血管组织时,会改变基因表达,促进组织重塑事件,进而增强特定的机械和表型特征。天然心脏瓣膜会受到高度复杂的周期性、拉伸和液体引起的应力。在工程心脏瓣膜组织中,机械刺激,尤其是结合液体引起的剪应力的刺激,可增强祖细胞分化途径并构建用于瓣膜应用的组织特性。例如,研究人员使用脉动流生物反应器装置进行实验,该装置增强了 TEHV 三叶结构,与静态培养的对应物相比,胶原蛋白细胞外基质 (ECM) 含量增加了约 300%。在其他地方,已经建造了生物反应器来耦合任何组合的流动、循环拉伸和循环弯曲 (FSF 生物反应器),这也证实了耦合的机械刺激显着促进 ECM 的产生;特别是,与心脏瓣膜相关的稳定流与循环弯曲的组合,研究人员表明,血流诱导的振荡剪切应力 (OSS) 直接调节斑马鱼模型中来自 kruppel 样因子基因家族 KLF2A 的转录因子的正常表达。KLF2A 基因与瓣膜形成密切相关,其缺失会导致心脏瓣膜缺陷。
由于缺乏有关优化体外培养过程所需的机械生物学事件的信息,功能性 TEHV 的生成仍然难以捉摸。尽管如此,在机械指导下,组织工程可行性研究迄今已证明,天然瓣膜细胞可以重现具有足够机械强度和形态的瓣膜结构。此外,非瓣膜细胞,如骨髓干细胞 (BMSC)、隐静脉内皮细胞 (EC)、升主动脉肌成纤维细胞和脐带衍生细胞,在机械调节状态下表现出瓣膜 ECM、DNA 含量和体外内皮化的增加。
BMSC 尤其在心脏瓣膜组织工程方面显示出巨大的前景,因为它们是多能干细胞,免疫原性风险极小,没有道德/法律问题,并且可以轻松获取和培养扩增;通常,BMSC 可以在几天内分离、纯化并大量扩增。BMSC 在体外保持广泛的分化、增殖和克隆形成能力。人类 BMSC 对机械调节有反应,并且已被证明可以在体外产生心脏瓣膜 ECM 成分。研究人员描述了阐明组合循环弯曲和稳定流动状态 (flex-flow) 的影响的开创性工作,这有助于显著促进源自 BMSC 的从头工程心脏瓣膜组织中的工程胶原蛋白。然而,在组织规模上评估 TEHV 研究的一个基本前提是需要了解瓣膜相关机械刺激可以调节细胞命运的过程,特别是在干细胞来源的背景下的细胞分化。因此,在这项研究中,我们的主要目标是确定 BMSC 对 flex-flow 条件在促进瓣膜形成方面的独特反应。
二、材料与方法
2.1 BMSCs 培养与扩增
从人骨髓中分离的 BMSCs,用基质、干细胞和造血标志物进行表征和测试,购买于冷冻小瓶中。从干冰包装中回收细胞,立即解冻并用预热的培养基稀释,以减少到达时冷冻保存试剂的毒性作用。将约 5 x 10^5 个细胞转移到 T75 通风细胞培养瓶中,并置于 37℃、湿度为 95%、CO2 为 5% 的培养箱中。培养瓶在 1 周时完全汇合。每次传代平均获得 2 x 10^6 个细胞。使用新鲜配制的干细胞培养基(含 10% 高级干细胞未分化生长补充剂、1% 青霉素和链霉素培养基)进行细胞培养与扩增。在整个实验过程中,我们一直保持无菌细胞和组织培养环境。第 6 至 8 代的 BMSC 用于后续的组织工程实验。
2.2 支架制备和细胞接种
支架材料为等比例的聚乙醇酸 (PGA) 和聚 L-乳酸 (PLLA) 无纺布聚合物毡 。切割长 17 毫米、宽 6 毫米、厚 1 毫米的样本 (n = 12),并将两个金属弹簧小心地连接到支架的两端。在我们定制的 U 形生物反应器装置中进行动态组织培养需要此组件 (图 1);更多图纸和细节可参见研究人员的文章。在细胞接种之前,用环氧乙烷 (EtO; AN 306, Anprolene, Andersen Products Inc, HawRiver, NC) 对支架进行气体灭菌 12 小时,并用 70% 乙醇处理。按照制造商的说明指南中所述的建议进行曝气程序。使用以下方案完成接种程序:用杜氏磷酸盐缓冲盐水 (DPBS, Fisher Scientific) 缓冲液冲洗约 90% 的汇合烧瓶。接下来,加入 0.25% 胰蛋白酶和乙二胺四乙酸 (EDTA) 溶液,在 37℃ 下孵育 3 分钟。用等体积的血清中和胰蛋白酶溶液。将细胞悬浮液收集在 15 毫升锥形管中,以 1700 rpm 的速度离心 5 分钟。通过去除上清液回收细胞沉淀,并用新鲜制备的组织培养基悬浮以供进一步使用。单个支架上接种了 2 x 10^6 BMSC,并悬浮在 50 毫升通风锥形管中的 20 毫升组织培养基中。组织培养基由杜尔贝科改良的 Eagle 培养基 (DMEM,Fisher Scientific) 组成,其中补充了 10% 胎牛血清、1% 青霉素和链霉素、2ng/ml 碱性成纤维细胞生长因子和 82 μg/ml 抗坏血酸 2 磷酸盐 (AA2P,Sigma-Aldrich)。随后,将这些管放入细胞和组织培养箱内的旋转式烤盘中,转速为 8 RPM。每两天更换一次培养基,并将 BMSC 接种的支架在旋转式烤盘培养下培养,总共 8 天。

东莞市富临塑胶原料有限公司 是 PLGA Biofelt植入级无纺布的专家, 富临塑胶为客户提供“服务”和“PLGA Biofelt无纺布”。
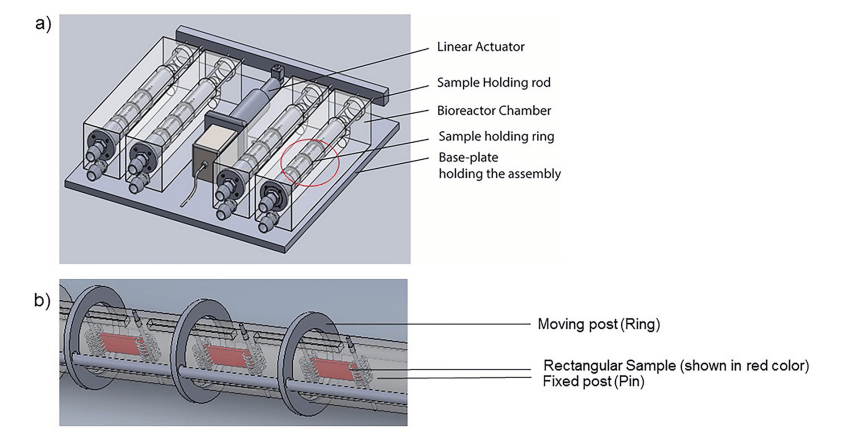
图 1. a) 定制 U 形生物反应器的示意图,该生物反应器连接到线性致动器,该致动器引导穿过样品的杆,使它们弯曲和伸直。b) 插图:显示调节室内的三个样品,一端(环)可以移动,另一端(销)固定。在当前研究中,致动器设置为 1 Hz 频率以允许周期性弯曲,同时泵以 850 ml/min 的稳定流速运行。
2.3 组织工程实验
在前 8 天的旋转培养后,将样本随机分配到四个不同的处理组之一,并进行额外的 14 天组织培养。这些组为(n = 12 个样本/组):1) 无流动(静态控制),2) 单独稳定流动(流动),3) 单独样本循环弯曲(弯曲)和 4) 稳定流动和样本循环弯曲的组合(弯曲流动)。对于机械调节组,使用之前详细描述过的定制 U 形生物反应器。该装置连接到蠕动泵和环境密封的线性执行器以用于实验目的。实验装置由四个相同的调节室组成,每个室包含 3 个样本。标本的一端用销钉固定,另一端连接到圆形移动柱上。对于 Flex 和 Flex-Flow 实验,移动柱沿轴向线性移动,使用线性致动器(频率为 1 Hz)启动样品循环弯曲。对于 Flow 和 Flex-Flow 案例,使用蠕动泵来维持 850 ml/min 的连续流速(S1 文件)。
2.4 胶原蛋白含量
所有四组的样本在 22 天后取出(每组 n = 3)并进行胶原蛋白生化测定。消化的胶原蛋白样品的定量方法与之前描述的方法类似。用 0.5 M 乙酸溶液(Sigma)和胃蛋白酶(1 mg/ml 胃蛋白酶(P7000),Sigma)消化样品。在摇床上在 4℃ 下进行 16 小时的消化。然后根据 Sircol 可溶性胶原蛋白测定试剂盒(Biocolor Ltd.)提供的体外组织程序对胶原蛋白提取物进行测定。将多模式微孔板读数仪设置为 555 nm 的吸光度以获得胶原蛋白浓度。
2.5 组织学
为了检测关键瓣膜 ECM 成分(胶原蛋白、糖胺聚糖 (GAG) 和弹性蛋白)的存在,对培养的工程组织和新鲜收获的猪天然主动脉瓣叶(作为阳性对照)进行了组织学处理。在室温下,用 DPBS 清洗样品,并用 10% 福尔马林固定过夜,体积分数为 20:1。固定后,用剪刀剪下 2 毫米 x 2 毫米的组织切片,并嵌入组织冷冻培养基中。为了保留结构,将组织在室温下用液体冷冻培养基在培养皿中孵育 2 小时。接下来,还将液体冷冻培养基单独添加到塑料模具中,并在液氮温度下冷冻。约 1 分钟后,获得白色固体冷冻介质床。此时,将准备好的组织切片小心地放在模具内的冷冻固体床上,并添加更多冷冻介质以浸泡样品。随后将模具在液氮中速冻。最后,使用低温恒温切片切割与组织表面平行的连续切片(厚度为 12 μm)。将切片安装到玻璃载玻片上。使用制造商提供的染料将组织学染色剂应用于组织切片,以便随后进行显微镜可视化。
2.6 免疫荧光染色
22 天后对 CD31 和 α-SMA 细胞表面蛋白进行免疫荧光染色(n = 3 个样本/组),以分别检测内皮和肌成纤维细胞表型。本研究重点关注两种瓣膜相关蛋白,例如分化簇 31 (CD 31) 和 α-平滑肌肌动蛋白 (α-SMA)。已知 CD31 表达于 EC 表面和 SMC 中的 α-SMA,以及瓣膜间质细胞中的肌成纤维细胞样细胞。每个样本沿组织切片,用抗 αSMA 和抗 CD31 对三个不同层(即顶部表面层、深层中核层和底部表面层)进行免疫染色,并评估 SMC 和 EC 表达情况。解剖从心脏分离的猪主动脉瓣膜并将其指定为阳性对照。按照相同的方案对瓣膜小叶进行免疫染色以检测 EC 和 SMC 表达。
样品固定、包埋和切片程序与前面描述的组织学方案相同(“材料和方法”中的“组织学”子部分)。接下来,对于免疫荧光检测,遵循以下染色程序:将安装在玻璃载玻片上的组织切片用 0.1% Triton X-100 处理 3 至 5 分钟以增强细胞质的通透性(CD31 染色不包括此步骤)。用 DPBS 进行额外的洗涤步骤三次,每次 5-10 分钟。通过在 DPBS 中加入 1% 山羊血清 30 分钟来促进非特异性表位的阻断。所用的一抗为小鼠单克隆抗 CD31 和小鼠单克隆抗 α SMA。在 4℃ 下孵育过夜。用洗涤缓冲液 (DPBS+ 0.01% Triton-X 100) 洗涤样品以降低背景。加入二抗 (山羊多克隆抗小鼠 IgG (H+L) (DyLight 488) (Fisher Scientific) 含 1% 山羊血清),并在 4℃ 下孵育过夜,以进行 CD31 和 α-SMA 免疫荧光染色。在荧光显微镜下观察带有染色切片的玻璃载玻片。对于 CD31,距离表面顶部 92±10.58 μm 的深度被视为顶层,距离底部表面 76±4 μm 的深度被视为底层,距离顶部表面 264±18.33 μm–652±17.43 μm 的深度被视为深层中芯层。同样,对于 α-SMA,距离顶部表面 ~140±17.43 μm 的深度被视为顶层,距离底部表面 ~108±12 μm 的深度被视为底层,距离顶部表面 336±13.85 μm–464±21.16 μm 的深度被视为深层中芯层。
2.6.1 图像分析
使用以下协议 (ImageJ, NIH; Bethesda, MD) 量化 CD31 和 α-SMA 染色图像 (样本大小, n = 3) 的信号强度值。定义一个面积为 10,000 像素的矩形感兴趣区域 (ROI)。选择并测量三个具有最大强度的不同 ROI (重复, r = 3)。ROI 的平均强度以任意单位 (AU) 记录。注意避免任何假阳性信号。
2.7 定量实时聚合酶链式反应 (QRT-PCR)
组织培养 22 天后,对四组新生组织进行基因表达评估,并对有限数量的瓣膜相关标志物进行量化,以验证免疫染色结果。如前所述,进行定量实时聚合酶链式反应 (QRT-PCR)。用 DPBS 清洗工程组织,并根据制造商的方案 (SV Total RNA Isolation System,Promega) 分离总 RNA,从小组织样本 (≤30mg) 制备裂解物。简而言之,将 1ml 裂解缓冲液加入 30 mg 组织中,然后快速冷冻并用均质机高速均质,直至混合物中没有可见的组织碎片。将 175 μl 组织裂解物转移到 1.5 ml 微量离心管中。将沉淀物转移至 1.5ml 无 RNase 微量离心管中进行 RNA 分离。用 SV 总 RNA 分离系统 (Promega) 纯化总 RNA。利用分光光度计 (Varian Carry 300) 验证分离的 mRNA 浓度和质量。所有样品测量均准备了 60 倍稀释液。RNA 纯化数据在补充数据表 (S3 文件) 中提供。1 μg 总 RNA 用于逆转录反应,并使用 GoScript 逆转录系统 (Promega) 提供的寡核苷酸 (dT) 15 引物合成 cDNA。使用 GoTaq_qPCR Master Mix (Promega) 进行 QRT-PCR。用 Step-One 实时 PCR 系统 (Applied Biosystems) 检测信号强度。PCR 混合物包含正向和反向引物以及 SYBR 绿 I 染料试剂,以及从逆转录中获得的 cDNA。引物和基因均选自参考来源,所有引物均购买(Sigma Aldrich)。引物序列(表 1)GAPDH、YARS、KLF2A 序列使用 BLAST 程序获得,国家生物技术信息中心 (NCBI),FZD2 和 MLC1F 来自研究人员。简而言之,实验所用的条件如下:PCR 管在 95℃ 下保持 2 分钟,然后开始循环以激活 Taq 聚合酶。循环参数为 95℃ 持续 5 秒;60℃ 持续 45 秒;95℃ 持续 15 秒。使用试剂指南中描述的 ΔΔCt 方法,对阈值循环 (ΔCt) 值的变化取平均值,并用内源基因 GAPDH 进行标准化。基因倍数变化的表达计算为 2- ΔΔCt,并比较四组(Static、Flow、Flex 和 Flex-Flow、PHV)的基因表达率以进行进一步分析。在每个完整的 QRT-PCR 循环后进行熔解曲线分析,以检查任何污染、引物质量或重复扩增。GAPDH、YARS、FZD2、MLC1F、KLF2A 的熔解温度 (Tm) 分别记录为 (82.6±0.001)℃、(80.05±0.007)℃、(81.97±0.08)℃、(79.91±0.09)℃ 和 (79.92±0.001)℃。每组的熔解曲线在补充数据(S4 文件)中提供。
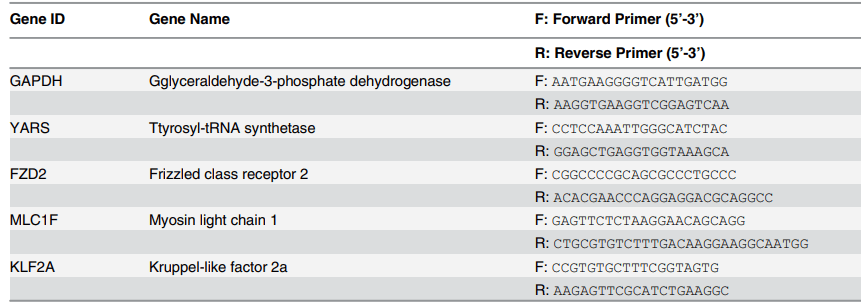
表 1. 本研究中用于 RT-PCR 分析的引物序列。
2.8 计算流体动力学 (CFD)
为了量化施加在生物反应器样品上的流体诱导应力,我们进行了 CFD 模拟。对于单独的弯曲流动和循环弯曲的情况,我们结合了移动边界分析;我们之前的工作详细描述了 CFD 方法的细节。模拟了单独流动、单独循环弯曲、流动和弯曲组合以及无流动四种情况。对于单独的弯曲流动和稳定流动的情况,我们使用了 0.1067 m/s 的入口速度边界条件,这代表了实验规定的 850 ml/min 的流速。生物反应器壁没有规定滑移条件,而对于单独的弯曲流动和循环弯曲,样品壁的速度设置为等于网格速度。生物反应器的出口设置为零相对压力边界条件。所有模拟均采用牛顿粘性模型,采用层流条件,流体材料特性如下:密度 = 1.01g/cm³,动态粘度 = 1.27 cp。在满足每个动量、连续性和网格位移方程的 1x10^(-9) 收敛标准后,对结果进行分析。所有模拟均在 Hewlett Packard 工作站上进行,工作站配备英特尔 (R) Xeon(R) CPU、x5550@ 2.67GHz(2 个处理器),安装内存为 16.0 GB,操作系统为 64 位 Windows 7。
为了表示剪切应力大小和流动中时间振荡的耦合效应,我们使用了振荡剪切指数 (OSI) 缩放的剪切应力大小,我们之前将其定义为:


其中 TSSM 是时间平均剪切应力大小。OSI 本身定义为:
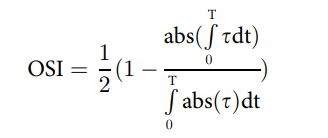
其中,“τ”是流体引起的剪切应力,“T”是周期,“t”是时间。OSI 范围从 0 到 0.5;OSI 为 0 表示单向流动,而 OSI 为 0.5 表示流动中存在高度的时间振荡(S5 文件)。
2.9 统计分析
进行单因素方差分析,以检验四组胶原蛋白生成、图像分析和基因表达结果之间的显著差异(n = 3 个样本/组/结果)。随后进行 Tukey 事后检验,以确定各组之间的显著差异。所有统计分析均使用社会科学统计软件包 (SPSS) 软件进行。观察到各组之间的显著差异发生在显著性水平 p < 0.05。
三、结果
3.1 胶原蛋白含量
生理相关的柔性流动机械调节进一步增强了工程 ECM 中的胶原蛋白:胶原蛋白是心脏瓣膜组织中的关键结构蛋白,在周期性弯曲、周期性拉伸和脉动流机械状态下不断重塑。针对心脏瓣膜的组织工程,我们研究了生理相关尺度下的弯曲和/或稳定流动模式的机械刺激如何促进 BMSCs 衍生的新生组织中的胶原蛋白含量。
静态组的平均胶原蛋白产量为 40.91±4.23(无流动、无弯曲)、93.29±12.6(仅流动)、69.75±2.68(仅周期性弯曲)、207.38±36.61(柔性流动)μg/g 湿重(图 2)。与其他三组相比,flex-flow 组的胶原蛋白含量明显较高 (p<0.05)。静态组、仅流动组和仅 flex 组之间没有显著差异。这一观察结果与先前的研究结果一致。为了进行比较,评估了猪主动脉瓣叶的胶原蛋白含量 (n = 3 个瓣叶),结果为 2141.17±491.56 μg/g 湿重 (S2 文件)。
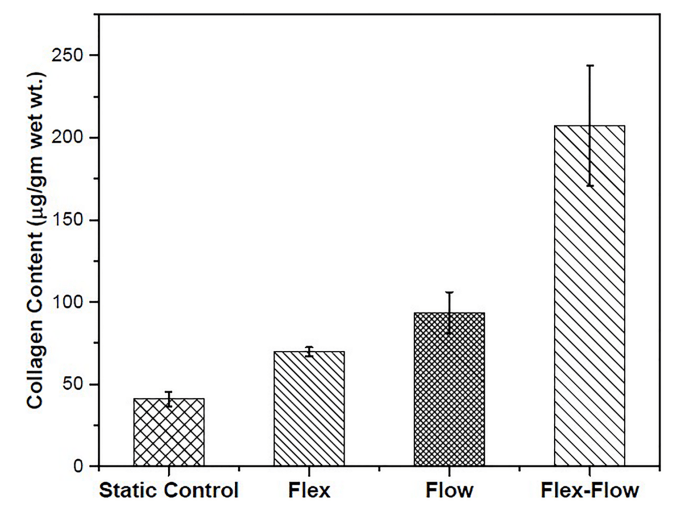
图 2. 所研究各组样本中的胶原蛋白含量。与所有其他组相比,Flex-Flow 组产生的胶原蛋白明显较高 (p < 0.05)。
3.2 组织学
BMSC 植入支架的 Flex-Flow 调节可增加 ECM 中胶原蛋白和 GAG 的存在:暴露于瓣膜相关机械刺激的 BMSC 衍生工程组织经过组织学处理,以可视化瓣膜基质的三个关键 ECM 成分:胶原蛋白、GAG 和弹性蛋白。
经过 8 天的静态培养后,在生物反应器中接受 Flex-Flow 机械调节 14 天的样本显示出工程组织 ECM 中存在胶原蛋白和 GAG 的证据(图 3)。然而,弹性蛋白的存在尚不确定,很可能不存在,这通常是体外生长的瓣膜组织的情况。
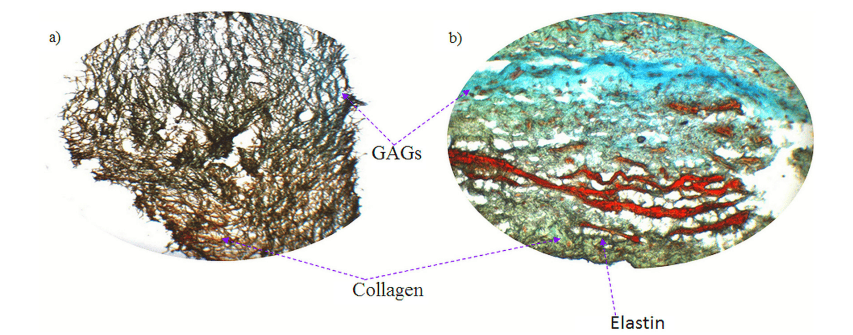
图 3. Russell 的 Movat 五色组织学染色:a) 培养 22 天后 BMSC 接种支架的全厚度切片(8 天静态 + 14 天 Flex-Flow 调节,b) 天然猪主动脉瓣叶的全厚度切片(+ve 对照)。颜色代码蓝色:糖胺聚糖 (GAG),黄绿色:胶原蛋白,黑色:弹性蛋白,红色:肌肉,天然瓣膜 ECM 的三个主要成分中,胶原蛋白和 GAG 在组织工程结构中清晰可见;然而,弹性蛋白的存在尚不确定,可能不存在。
3.3 免疫荧光染色
Flex-Flow 条件促进 BMSC 分化的内皮细胞和平滑肌细胞在工程组织中的瓣膜样分布:为了评估分化的 BMSC 在动态培养后如何在新生 ECM 中分布,对从表面到结构内更深层的工程组织连续切片进行了免疫染色。
仅在 flex-flow 组中,与瓣膜小叶表面相比,α-SMA 在中间核心层中显着(p < 0.05)(图 4a 和 4b)。此外,与标本的中间核心区域相比,仅在 flex-flow 组中,表面层(顶部和底部)中内皮标志蛋白 CD31 丰富(p < 0.05)(图 5)。所有其他组均未产生 CD31 和 α-SMA 的表达(静态、仅弯曲组)或随机分布(仅流动)(S2 文件)。
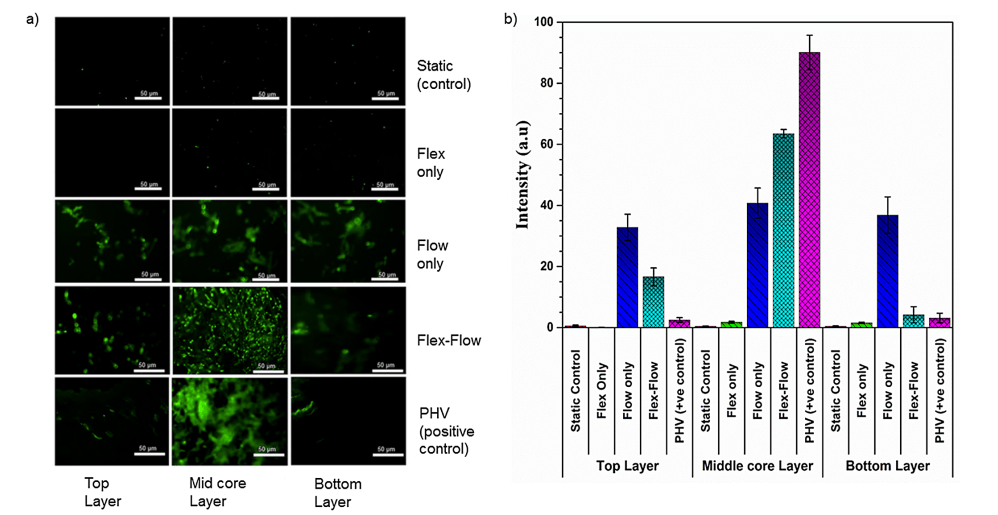
图 4. a) 瓣膜两个表面层(每侧厚度约 90μm)、中间核心(间质组织)区域(厚度约 400 μm)上的 α-SMA 蛋白的免疫荧光染色;第一行:静态对照;第二行:Flex;第三行:Flow;第四行:Flex-Flow 条件作用;第五行:猪心脏瓣膜作为阳性对照。在实验组中,仅在 Flex-Flow 组中,发现 α-SMA 表达细胞在工程组织间质区域(中间层)内占主导地位;b) 量化四个实验组中 α-SMA 信号强度的阳性染色(绿色;来自部分 a 中的图像);与对照组相比,暴露于 flex-flow 的样品表达的阳性 α-SMA 水平明显更高(p < 0.05)。将 PHV 视为阳性对照。
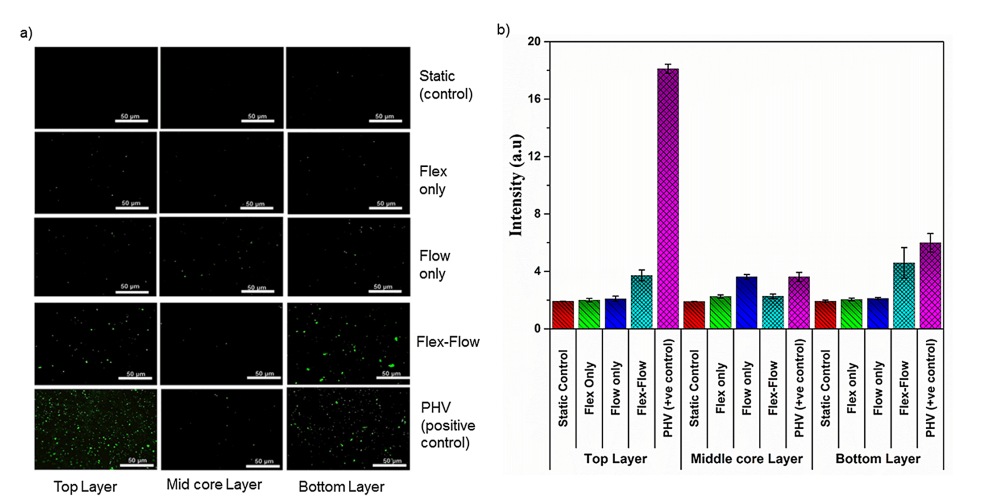
图 5. EC 标记 CD31 在瓣膜组织的两个表面层(每侧厚度约 90μm)、中间核心部分(厚度约 400 μm)上的免疫荧光染色;第一行:静态对照;第二行:Flex;第三行:Flow;第 4 行:Flex-Flow 条件;第 5 行:猪心脏瓣膜作为阳性对照。在实验组中,仅在 flex flow 组中,CD31 表达细胞在工程组织的浅层(顶层和底层)内可见。b) 四个实验组中 CD31 信号强度的阳性染色(绿色;来自部分 a 中的图像)的量化;与对照组相比,暴露于 flex-flow 的样本表达的阳性 CD31 水平明显更高(p < 0.05)。PHV 被视为阳性对照。
3.4 基因表达
Flex-Flow 条件表明支持瓣膜表型的早期证据:对选定标记物的初步基因表达进行了评估,以确定组合的 FlexFlow 条件是否增强了体外生长结构中的心脏瓣膜表型。
在从 flex-flow 组中提取的 RNA 中观察到 FZD2 和 YARS 标记物(心血管 SMC(当 MLC1f 未表达时)和 EC 相关基因)的最高表达水平,其中样品暴露于生物反应器中的组合循环弯曲(1 Hz)和流动(850 ml/min)条件(图 6);请注意,MLC1f 仅在无流量对照组中显着表达(P < 0.05)。与研究的其他组(无流量控制、仅流量、仅周期性弯曲)相比,在弯曲流动情况下,对瓣膜发育中的瓣膜形成至关重要的转录因子 KLF2A 也显著表达(p<0.05)(S2 文件)。
图 6. BMSC 衍生的工程瓣膜组织的基因表达。研究的四个组为:静态对照、Flow(850 ml/min)、Flex(1 Hz)和 Flex-Flow(同时应用 850 ml/min 流速和 1Hz 频率对标本进行循环弯曲)。细胞培养基在生物反应器调节室中循环的流速为 850ml/min,允许在内壁和外壁上分别产生 2.91 达因/cm² 和 4.73 达因/cm² 的生理相关 4 流体诱导平均剪切应力。PHV 被视为阳性对照,作为参考。
3.5 计算结果
Flex-Flow 培养标本的剪切应力大小和振荡属于心脏瓣膜的生理范围和剪切应力分布:量化组织工程标本上流体诱导的剪切应力空间和时间分布需要进行 CFD 模拟,然后对结果数据进行分析。
在所有模拟情况下,在内表面和外表面上绘制了流体诱导的时间平均剪切应力大小 (TSSM)(图 7)。静态控制、单独稳定流、单独循环弯曲和弯曲流动情况下的内壁 TSSM 值分别为 0 达因/厘米²、1.98 ± 0.37 达因/厘米²、0.1 ± 0.005 达因/厘米² 和 2.91 ± 0.11 达因/厘米²。控制、单独稳定流、单独循环弯曲和弯曲流动情况下的外壁 TSSM 值分别为 0 达因/厘米²、2.43 ± 0.06 达因/厘米²、0.1 ± 0.003 达因/厘米² 和 4.73 ± 0.09 达因/厘米²。
图 7. 以下四种情况下,在试样内壁和外壁上,一个周期内流体诱导的时间平均剪切应力:i) 静态控制、ii) 流动、iii) 弯曲和 iv) 柔性流动状态。在比较两种动态情况 (iii) 与 (iv) 时,柔性流动状态显示出更高的剪切应力值。
而外壁(n = 3)的相应值分别为 0.313± 0.011 和 0.094± 0.10。确定面积平均 OSI指标以量化实验中耦合剪切应力大小和时间振荡的程度。在样本区域(样本大小 n = 3/组),内壁的面积平均 OSI为 0.1±0.05 达因/厘米²(单独循环弯曲)和 0.41±0.11 达因/厘米²(弯曲流动),而外壁的面积平均 OSI为 0.16 ±0.03 达因/厘米²(单独循环弯曲)和 0.27±0.16 达因/厘米²(弯曲流动)(图 8)。请注意,如果流动在时间上是单向的,或者流体引起的剪切应力可以忽略不计,则 OSI- 2 = 0,这分别是单独稳定流动和无流动的情况。
图 8. 动态柔性和柔性流动情况下,样本内外表面的 OSI 缩放剪切应力大小。
四、讨论
功能性心脏瓣膜置换,特别是儿科危重瓣膜疾病,迫切需要合适的治疗方法;主要限制是,目前可用的置换装置无法提供躯体生长。因此,自体和活体生物心脏瓣膜替代品的概念非常有吸引力。多项研究表明,开发坚固的工程瓣膜组织的过程需要一个动态培养过程,其中机械应力(例如流动、弯曲和拉伸)会施加到生长的结构上。这些应力状态尤其重要,因为瓣膜小叶在心动周期中经历高度变化且依赖于小叶侧的流体诱导剪切应力分布,以及局部周期性组织拉伸和弯曲。例如,在主动脉瓣中,与动脉侧相比,小叶的心室侧经历的流体诱导剪切应力明显更高。一些体外研究已经能够重现这种血液动力学环境的重要特征,使用生物反应器从头生长瓣膜组织。然而,体外机械调节对结构内细胞分布和表型的具体影响仍不清楚。这些属性可以支持工程化组织与天然组织的整合,从而可以在指导体内后续瓣膜重塑事件中发挥关键作用。此外,维持生理范围的调节参数(例如流体诱导的剪切应力)的重要性也未得到充分解决。另一方面,迄今为止,干细胞(如 BMSCs)的效用已在几种心脏瓣膜组织工程方法中得到探索,这些方法已证明在机械刺激环境下组织生长强劲。因此,为了确定瓣膜相关应力环境对干细胞表型的影响,以及机械调节的生理尺度的影响,我们将 BMSC 植入支架置于流体剪切和弯曲应力状态的单独和组合模式中,这两种状态都与瓣膜组织高度相关。
我们发现 flexflow 组的 BMSC 衍生胶原蛋白含量相对于其他组显著增加 (p<0.05),而静态控制、Flex 和 Flow 组之间没有发现显著差异 (图 2)。我们的观察结果与先前的发现一致,其中亚生理剪切应力下的 flex-flow 研究 (平均壁面剪切应力 = 1.15 达因/厘米²) 与生理水平的周期性弯曲 (1Hz,相当于心率为 60 次/分钟) 相结合。然而,我们试图在我们工程组织标本上重现天然主动脉瓣液诱导剪切应力分布的区域变化和侧面特异性。事实上,先前的工作已经证明,我们标本的内壁和外壁类似于瓣叶的主动脉侧和心室侧。在这里,在弯曲流动状态下,外壁上的 TSSM 为 4.73 达因/厘米²,而沿内壁,剪切应力为 2.91 达因/厘米²。天然人类主动脉瓣的心室侧暴露于约 3.87 达因/厘米² 的 TSSM,因此,本研究中确定的弯曲流动标本的剪切应力具有生理相关性。将我们的研究与在亚生理剪切应力水平下进行的研究进行比较,我们发现胶原蛋白的产生额外增加了 70%,即当标本的剪切应力大小和分布在区域上与天然主动脉瓣叶相似时。我们注意到,早期的一项研究通过体外模拟动脉压力条件证明了生理调节尺度的重要性,最终导致胶原蛋白含量与亚生理流动环境相比增加了约 35%。我们推测,在我们的案例中,差异更为明显,这是由于细胞调节机制直接导致的,已知这些机制是由流体诱导的剪切应力启动的,我们认为这些机制也适用于分化 BMSC。
先前的研究已经检查了 TEHV 中细胞的全厚度分布和表型。与采用亚生理范围剪切应力调节的柔性流动研究一致,我们观察到内皮细胞表达主要在表面表达,在间质层中可忽略不计(图 4)。我们认为,在流动状态下,BMSC 向内皮细胞的分化和支架内 BMSC 迁移模式得到增强,并且与流量大小没有很强的依赖性。事实上,我们之前通过磁共振成像可视化并监测了细胞支架迁移模式的增加,发现与无流量控制相比,在稳定流动条件下,这种增加得到增强。另一方面,机械环境与新生瓣膜组织内 α-SMA 表达细胞之间的联系并不那么简单。研究人员证明,在受到产生亚生理量级的流体诱导剪切应力的弯曲流动状态后,表达 α-SMA 的 BMSC 会优先分布在工程心脏瓣膜组织的表面,并表现出强劲表达。同时,Hoestrup 及其同事描述了在生物反应器中受到生理压力范围(30 至 75 mmHg)的三叶工程瓣膜结构中表达 α-SMA 的 BMSC 的一致分布;此外,细胞密度在 TEHV 表面最大,而在组织深处则稀疏。我们观察到,应用心脏瓣膜生理相关的流体诱导剪切应力(TSSM,内壁:2.91dyne/cm² 和外壁:4.73dyne/cm²)有助于促进细胞形成,尤其是表达 αSMA 的 BMSC(图 4)。虽然这种情况在单独流动和弯曲流动条件下都会发生,但只有在后者中,α-SMA 表达细胞在工程组织的间质区域内占主导地位,而在表层上则稀疏。另一方面,如前所述,仅在弯曲流动组中,具有内皮表型的 CD31 表达细胞优先分布在工程组织标本的表面上(图 5)。尽管 α-SMA 和 CD31 免疫荧光染色的程度不如天然瓣膜明显,正如基因表达结果中瓣膜相关标记物所证明的那样,很明显,弯曲流动调节的生理尺度以模仿天然瓣膜细胞分布的方式促进异质细胞分布。我们认为,在体外环境中实现异质性、瓣膜相关的 BMSC 分布和分化的能力在植入后持续组织重塑中起着关键作用,包括加速复制原生三层瓣膜结构。这种结构仅在 TEHV 植入后数周(16-32 周)的绵羊研究中观察到,并且仅限于更换肺动脉瓣,而不是更换要求更高的主动脉瓣或二尖瓣位置。因此,在心脏瓣膜疾病的特定情况下,例如在治疗婴儿严重的先天性主动脉瓣狭窄时,加速组织重塑可能特别重要,以跟上躯体生长的步伐。
作为瓣膜形成的进一步证据,我们发现与所有其他组相比,柔性流调节显着增强了(p < 0.05)KLF2A 基因(图 6)。在天然瓣膜发育过程中,KLF2A 的缺失会导致严重的瓣膜畸形,并直接受到振荡流体诱导的剪切应力的调节。有趣的是,我们能够证明,在柔性流动条件下,干细胞(而不是内源性瓣膜细胞,特别是 BMSC)也可能上调 KLF2A 的表达。我们之前的研究表明,OSS 在柔性流动条件下得到增强,因此很可能引发细胞 KLF2A 的上调。
当对 flexflow 组中观察到的 KLF2A 标记物表达与相应的天然瓣膜基因表达进行集体比较时,我们毫不意外地发现,天然瓣膜表达更高,约为 49%。与从天然瓣膜组织中获得的细胞的基因表达相比,在时间有限的体外培养环境中,BMSCs 的密度明显较低,很可能表现出截断的基因表达水平。然而,需要考虑的更广泛的论点是,体外瓣膜表型的促进,即使很小,也可能对增强植入后工程化与天然瓣膜组织之间的整合至关重要。从表型的角度来看,周围体内细胞环境对工程化结构的识别可能对旁分泌细胞信号传导事件至关重要,这将有助于确保 TEHV 的引导重塑,并最大限度地降低组织过度生长和不受控制的血管翳的风险。先前的研究已经证明了在 TEHV 中重现原生三层组织结构对于支持强大功能的重要性。同样,我们推测 BMSC 衍生的工程化构造的表型状态在植入前同样重要,我们在此表明其针对的是柔性流动机械调节下的瓣膜谱系。因此,我们解释为在体外培养工程组织期间的柔性流动机械调节以异质方式支持 BMSC 分化,即通过促进瓣膜内皮细胞和间质细胞表型。这一发现证实了我们之前的计算预测,即在柔性流动状态下同时存在 OSS 和临界剪切应力会协同增加工程组织中的胶原蛋白含量,这似乎也增强了瓣膜表型,正如这里所证明的那样。
总之,生理相关的弯曲流动状态有助于促进体外生长的 BMSC 衍生的工程心脏瓣膜组织中的细胞分布和表型。我们首次能够证明 BMSC 在工程组织内的分化和迁移导致表面衬里的内皮细胞标志物表达细胞和间质填充的肌成纤维细胞标志物表达细胞,从而类似于天然瓣膜细胞分布。此外,OSS 与临界水平的剪切应力的共存使得关键瓣膜基因(特别是 KLF2A)的非常早期阶段能够强劲表达。请注意,单独的弯曲状态会诱导 OSS,但具有可忽略不计的剪切应力大小,并且被发现不会增加工程组织内的细胞和表型;这与我们之前的发现一致,无论是时间方向性还是剪切应力的大小,在引发 BMSC 反应方面都很重要,我们在此展示了这可以在弯曲流动状态下通过实验实现。我们得出结论,通过生理相关的弯曲流动条件可以实现 BMSC 衍生的工程化心脏瓣膜细胞组成和表型的体外优化。刺激异质瓣膜细胞和表型的能力可能在指导瓣膜细胞分布的早期阶段以及随后的体内瓣膜组织重塑事件方面很重要,以确保儿科患者 TEHV 的长期成功。
公司地址:广东省东莞市樟木头镇塑金国际1号楼810
责任编辑: